7 0 0 0 OA 回転分子モーターの動作原理―F1モーターとV1モーターの違い―
- 著者
- 村田 武士
- 出版者
- 一般社団法人 日本生物物理学会
- 雑誌
- 生物物理 (ISSN:05824052)
- 巻号頁・発行日
- vol.54, no.2, pp.079-084, 2014 (Released:2014-03-28)
- 参考文献数
- 28
- 被引用文献数
- 1 1
F- and V-ATPases are unique bio- and nano-molecular rotary motors among many types of bioenergy-transducing machineries. The rotational catalysis of F1-ATPase has been investigated in detail, and the molecular mechanisms have been proposed on the basis of crystal structures of the complex and extensive single-molecule observation of the rotation. Recently, we have obtained crystal structures of bacterial V1-ATPase (A3B3 and A3B3DF complexes) with and without nucleotide. On the basis of these new structures, we present a novel model of the rotational catalytic mechanism for V1-ATPase, which is apparently different from those of F1-ATPases.
4 0 0 0 OA 生物界最速のミオシンの構造-機能相関
- 著者
- 伊藤 光二 原口 武士 玉那覇 正典 鈴木 花野 村田 武士
- 出版者
- 一般社団法人 日本生物物理学会
- 雑誌
- 生物物理 (ISSN:05824052)
- 巻号頁・発行日
- vol.63, no.2, pp.91-96, 2023 (Released:2023-05-25)
- 参考文献数
- 20
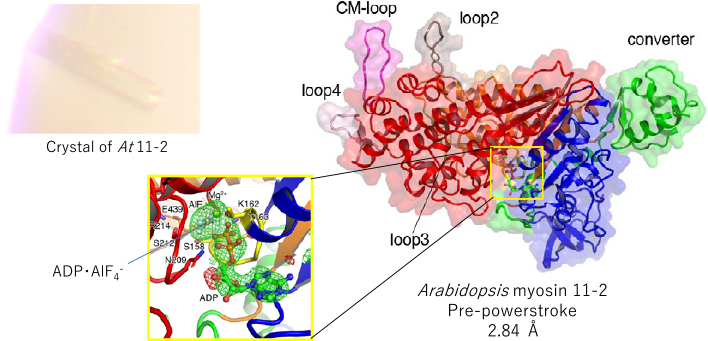
生物界最速ミオシンが淡水産藻類シャジクモに存在することが予見されていたが,その実体は不明であった.最近,私達はそのクローニングに成功し,さらに,最速のミオシンクラスであるミオシン11の高解像度結晶構造解析に世界で初めて成功し,最速ミオシンの秘密はアクチンとの結合領域にあることを明らかにした.
2 0 0 0 OA 分子動力学/自由エネルギー計算によるF-ATPase 触媒部位への基質結合親和性の算出
- 著者
- 末永 敦 梅津 倫 安藤 格士 山登 一郎 村田 武士 泰地 真弘人
- 出版者
- 日本コンピュータ化学会
- 雑誌
- Journal of Computer Chemistry, Japan (ISSN:13471767)
- 巻号頁・発行日
- vol.7, no.3, pp.103-116, 2008-09-15 (Released:2008-09-18)
- 参考文献数
- 36
- 被引用文献数
- 1 2
ATP 合成酵素であるF 型ATPase は, ほとんどの生物に存在する膜貫通型タンパク質であり, ATPの加水分解反応に共役した分子の回転が観察されている. ATPase活性を持つ最小単位はα3β3γ複合体であり, 触媒部位である3つのβサブユニットはATP結合型(βTP), ADP結合型(βDP),空の構造(βE)の3つの異なる構造が解明されている. それらβサブユニットの3つの構造は異なる基質親和性を持つとされ,実験的に基質親和性の測定がされてきた. しかし, ADPの親和性に関しては未知であり, γサブユニットの回転をもたらすβサブユニットの構造変化も解明されていない. そこで, 分子動力学法/自由エネルギー計算により触媒部位の基質ATPとADPを相互変換したときの自由エネルギー差を見積もり,さらにその基質変化に伴うβ サブユニットの構造変化を観察した. その結果, βDP の構造が最もADP との結合親和性が高いことが解った. この算出値は一分子観察の結果から推測された加水分解反応モデルを熱力学的知見から裏付けるものであった. さらに, βサブユニットの構造変化とγサブユニットの回転を共役する役目を持つと考えられているDELSEED配列(Asp394∼Asp400)付近の構造を観察したところ, 基質変換に伴い構造変化が確認された. すなわち, DELSEED配列近傍のPhe418∼Gly426 は, 触媒反応と構造変化, 回転を共役するのに重要な残基であることが示唆された. 以上の結果から, ATP加水分解・Piの放出に伴い, DELSEED 配列付近の構造が変化し, それがγサブユニットの回転をもたらすという分子機構の様子が明らかになった.
1 0 0 0 OA 今がチャンス!
- 著者
- 村田 武士
- 出版者
- 一般社団法人 日本生物物理学会
- 雑誌
- 生物物理 (ISSN:05824052)
- 巻号頁・発行日
- vol.63, no.5, pp.243, 2023 (Released:2023-11-25)
1 0 0 0 OA ナトリウムイオン駆動型膜内回転モーターの力発生機構の解明
細菌べん毛モーター回転のエネルギー源は、電気化学的ポテンシャル差によるイオンの流入である。海洋性ビブリオ菌Vibrio alginolyticusは、ナトリウムイオンで動く極べん毛を持つ。これまでに固定子内のイオン透過経路については、ほとんど研究が進んでいなかったが、ATR-FTIRを用いた測定によりNa^+結合部位をはじめて実験的に明らかにした。また、固定子タンパク質膜貫通部位への変異導入により、イオン透過経路を推測した。固定子構成タンパク質にGFPを融合させて、それらの局在の条件を調べたところ、Na^+依存的な局在を明らかにした。固定子のダイナミックな集合解離の重要性を示唆した。固定子タンパク質のペリプラズム側断片の結晶構造を解明しすることにより、大きな構造変化がイオンチャネルの活性化に必要であることを示唆することができた。